《免于进行临床试验的第二类医疗器械目录(第二批)》解读 聚焦医护人员防护用品
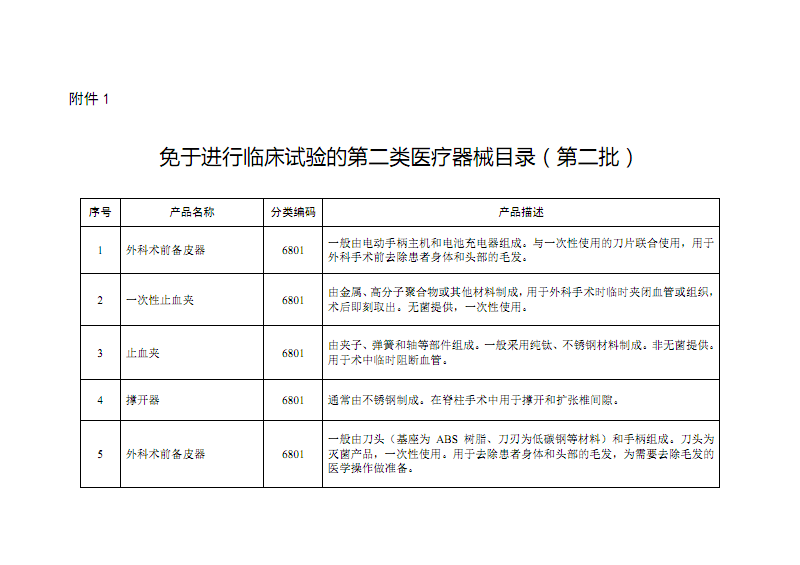
为深化医疗器械审评审批制度改革,优化监管资源配置,保障医疗器械安全有效,国家药品监督管理局依据《医疗器械监督管理条例》及《医疗器械注册与备案管理办法》等相关法规,持续发布并更新《免于进行临床试验的医疗器械目录》。其中,第二批目录的发布,将多种在临床实践中已广泛应用、风险可控、技术成熟的医疗器械纳入了免于临床试验的范畴,对于提升产品上市效率、满足临床急需具有重要意义。本批目录中,与医护人员防护相关的用品占据了显著位置,体现了对医务人员职业安全与健康的高度重视。
一、 目录意义与背景
临床试验是评估医疗器械安全性和有效性的重要手段,但也具有周期长、成本高的特点。对于部分设计成熟、作用机理明确、生产工艺稳定且在长期使用中已积累充分证据证明其安全有效的医疗器械,通过目录管理形式予以豁免临床试验,是科学监管、精准施策的体现。此举能有效缩短产品上市时间,降低企业创新成本,使医疗机构和医护人员能更及时地获取和使用安全可靠的防护装备。
二、 目录中涉及的医护人员防护用品概述
在第二批免临床目录中,医护人员防护用品主要涵盖以下几大类,这些产品通常属于第二类医疗器械,其设计、生产和使用旨在为医务人员在诊疗活动中提供物理隔离与屏障保护:
- 医用防护服/隔离衣:采用具有抗渗水性、抗合成血液穿透性及阻隔微生物颗粒的材料制成,用于为医务人员在工作时接触潜在感染性患者血液、体液、分泌物等提供阻隔与防护。
- 医用外科口罩/医用防护口罩:用于覆盖使用者的口、鼻及下颌,为防止病原体微生物、体液、颗粒物等的直接透过提供物理屏障。其中医用防护口罩(如符合GB 19083标准的口罩)防护等级更高。
- 医用隔离眼罩/面罩:用于保护医务人员的眼、面部,防止患者的血液、体液、分泌物等污染物在诊疗操作过程中发生喷溅、飞溅时造成的伤害与感染。
- 手术帽、鞋套等无菌屏障用品:在手术室等无菌操作环境中使用,用于减少医护人员自身脱落物(如皮屑、头发)对环境的影响,同时提供基础防护。
- 其他特定防护用品:如用于特定检查或操作的一次性防护袖套、胸巾等。
三、 免于临床试验的依据与条件
这些防护用品被纳入免临床目录,并非降低其安全有效性要求,而是基于以下科学和监管考量:
- 成熟技术与长期应用历史:上述产品制造工艺成熟,技术指标明确(已有相应的国家或行业标准,如YY/T 0506、GB 19082、GB 19083等),在国内外医疗机构中长期广泛应用,其防护性能和安全有效性已得到充分验证。
- 明确的风险受益比:产品预期用途清晰,风险明确且可控。其风险主要集中于材料生物相容性、屏障有效性及物理安全性等方面,这些风险可通过非临床研究(如材料检测、性能测试、生物学评价等)进行充分评估和控制。
- 注册申报路径优化:生产企业申请注册时,可依据目录豁免提交临床试验资料,但仍需提交详尽的产品性能研究资料、生物相容性评价研究资料、灭菌/消毒工艺研究资料、产品有效期和包装研究资料等非临床证据,并证明产品与目录所述产品具有等同性。这要求企业必须具备完善的质量管理体系,确保产品持续符合强制性标准和技术要求。
四、 对行业与临床实践的影响
- 加速产品供应:简化了合规防护用品的上市流程,有助于在常规需求及公共卫生应急情况下,快速提升合格防护物资的市场供应能力。
- 鼓励质量提升与创新:企业可将更多资源投入到原材料控制、生产工艺优化、质量体系维护以及真正意义上的产品创新(如提升舒适性、环保性、穿戴便捷性等)上。
- 保障医护安全:确保医疗机构能够稳定、及时地获取符合标准的防护装备,为医务人员构筑坚实的职业安全防线,是“以医务人员为中心”的切实举措。
- 强化企业主体责任:豁免临床试验不豁免任何安全有效性责任。企业需更严谨地完成设计验证与确认,并承担产品质量终身责任。监管部门将通过加强上市后监管(如抽检、不良事件监测)来确保风险可控。
###
《免于进行临床试验的第二类医疗器械目录(第二批)》将医护人员防护用品纳入其中,是医疗器械审评审批制度科学化、精细化、国际化发展的重要一步。它平衡了监管效率与产品安全,既回应了临床一线对可靠防护装备的迫切需求,也推动了医疗器械产业的高质量发展。对于生产企业和医疗机构而言,准确理解目录范围、适用条件和申报要求,是确保政策红利切实转化为保障医护人员健康与患者安全动力的关键。
如若转载,请注明出处:http://www.chinaskinhospital.com/product/75.html
更新时间:2026-01-12 01:28:53